发布时间:2025-05-09 21:28:45 点击量:
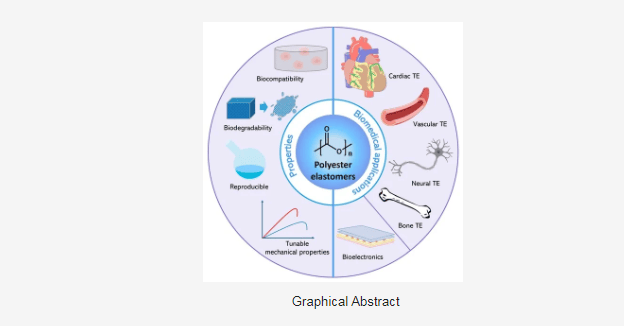
pg电子游戏,pg电子接口,pg电子官网,pg电子试玩,pg电子app,pg电子介绍,pg电子外挂,pg游戏,pg电子游戏平台,pg游戏官网,PG电子,麻将胡了,PG电子试玩,PG模拟器,PG麻将胡了,pg电子平台,百家乐,龙虎,捕鱼,电子捕鱼,麻将胡了2,电子游戏聚酯弹性体是一种柔韧性和弹性很强的材料,在各种生物医学应用中具有相当大的潜力,包括心脏、血管、神经和骨组织工程以及生物电子学。聚酯具有生物相容性、生物可降解性、可调机械特性以及简便的合成和制造方法,是未来商业植入物的理想候选材料。生物活性成分的加入进一步提高了聚酯弹性体在生物医学应用中的治疗效果。本综述讨论了有助于聚酯弹性体实现出色机械性能的新型结构改性方法。概述并分析了聚酯弹性体在组织工程和生物电子学方面应用的最新进展。此外,还对聚酯弹性体的未来研究和发展进行了展望。
许多聚酯都具有弹性,使聚合物在变形后能恢复原来的形状。弹性体是一种聚合物,其特点是具有粘弹性、相对较低的杨氏模量和较高的断裂伸长率。虽然许多材料都具有弹性区域,但 弹性体 一词通常用于描述具有高膨体弹性区域和大应变的材料,通常应变超过百分之几百。聚酯弹性体可分为物理交联聚酯和化学交联聚酯。物理交联聚酯通过结晶区、氢键和偶极力等物理相互作用进行交联。物理交联区通常包括结晶区和增强纳米填料,可提供交联位点和刚性。而弹性体中的无定形区则具有柔韧性。典型的物理交联聚酯包括聚(ε-己内酯)(PCL)、聚(乙醇酸)(PGA)、聚(乳酸)(PLA)及其共聚物。化学交联聚酯的聚合物链通过共价键相互连接,通常由多功能单体形成。例如,柠檬酸是一种具有三个羧酸基团的单体,可与具有两个羟基的醇类化合物发生反应,合成聚柠檬酸二醇酯(PDC)。为了与人体组织的机械性能相匹配,聚酯弹性体可以通过调整聚合物的单体、分子量、加工条件或结构设计,使其强度达到 MPa 范围,从而扩大其在组织工程、医疗植入物和药物输送方面的生物医学应用。

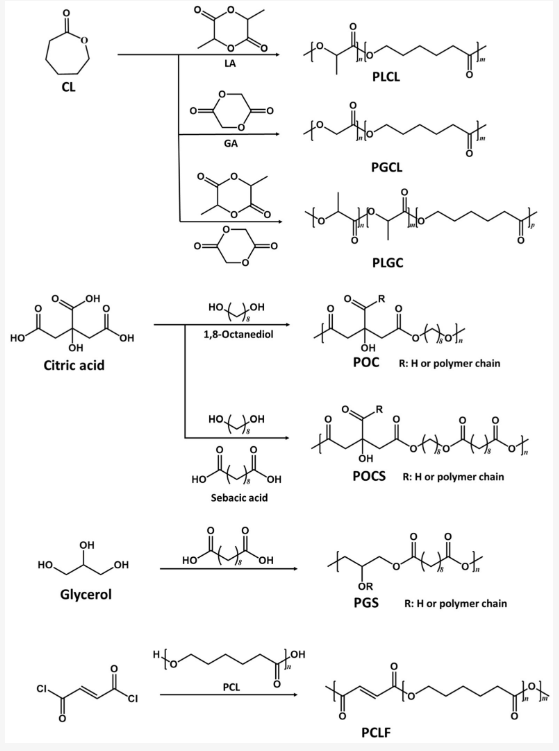
近年来,聚酯在生物医学研究和应用中发挥着越来越重要的作用。聚酯弹性体具有生物相容性、生物可降解性和可重复性,是异体移植的绝佳替代品(表 1)。目前已开发出先进的聚酯弹性体制造方法和技术,这些方法和技术采用了各种交联策略,并针对不同的生物医学应用设计了各种特性和功能。本综述将总结聚酯弹性体开发和评估的最新进展,并讨论其在生物医学领域的应用,包括心脏、血管、神经和骨组织工程以及生物电子学。此外,还将提供该领域的未来展望。
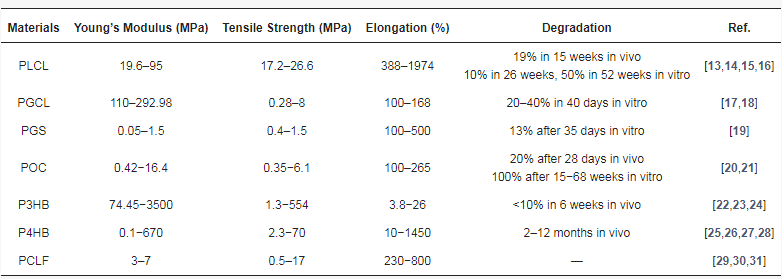
典型的物理交联聚酯包括聚乳酸(PLA)、聚乳酸(PCL)、聚丙烯酰胺(PGA)和它们的共聚物,这些聚合物具有生物相容性和生物降解性,是组织工程领域极具吸引力的合成聚合物。它们已被美国食品及药物管理局批准用于生物医学应用。它们的共聚物是一种热塑性弹性生物材料(图 1)。使用催化剂辛酸亚锡(II)[Sn(Oct)2],可通过开环反应聚合这些聚合物。通过优化共聚过程中的单体比例,可以对这些材料的机械性能和降解曲线进行微调。
具有代表性的化学交联聚酯弹性体包括聚(多元醇癸二酸酯)(PPS)和 PDC(图 1)。在 PPS 系列中,多元醇单体可以是生物质衍生单体,如甘油、异山梨醇、麦芽糖醇、赤藓糖醇和木糖醇。其中,聚(甘油癸二酸酯)(PGS)一直是吸引广泛研究的材料。许多脂肪族二元醇都被用来合成 PDC,其中研究最多的是 1,8-辛二醇。PPS 和 PDC 的聚合过程相似,通常包括两个步骤。首先,通过 -OH 和 -COOH 基团之间的酯化反应的热缩聚反应合成预聚物。反应温度和时间因所涉及单体的具体类型而异。其次,由于未反应的 -OH 和 -COOH 基团之间会发生共价交联,因此后聚合需要数天时间才能在理想状态下形成弹性体。
聚酯的体内生物降解性对其生物医学应用至关重要。为了研究其降解途径并确定最适合特定生物医学应用的材料,人们进行了广泛的研究。降解机制包括表面侵蚀和体积侵蚀。表面侵蚀型聚酯包括 PGS、聚(三亚甲基碳酸酯)(PTMC)、聚(碳酸乙烯酯)和聚(酸酐)。降解主要发生在材料表面,这些材料的质量损失和尺寸降低与表面积有关。因此,在降解过程中,这些材料的完整性得以保持,在达到预期处理目的之前,其特性将保持不变。块状侵蚀聚酯主要包括脂肪族聚酯和 PDC。这些聚酯弹性体的降解发生在块状材料内部,导致分子量下降。在初始阶段,材料的质量保持相对稳定,但其特性会发生显著变化。随着分子量逐渐降低并达到极低值,材料最终会崩溃或解体,导致降解产物快速释放,从而改变局部微环境或引起组织反应。如果块状侵蚀弹性体被设计用于输送生物活性剂,其突然崩解可能会导致药物快速释放,从而对患者造成危害。相比之下,表面侵蚀支架可以提供相对稳定的给药效果,因此在生物医学应用中更受欢迎。
为了获得具有多种特性的弹性体,人们对功能化进行了探索。对于聚酯弹性体,掺入聚氨酯、烯基改性和掺入硅等改性方法已得到广泛研究。事实证明,掺入聚氨酯单体的聚酯可提高弹性体的机械性能,同时保持其生物相容性。丙烯酸化聚酯保留了生物降解性和生物相容性,并具有光固化性,有助于三维打印。例如,在聚(辛二醇-柠檬酸)(POC)骨架中引入了伊塔康酸作为不饱和成分,有助于控制弹性体的快速固化。这些弹性体是凝胶状聚合物,可根据用途将其 3D 打印成各种形状。通过调整反应时间和单体的摩尔比,合成出了具有广泛弹性的材料(杨氏模量范围为 36-1476 kPa),这表明了材料的机械可调性。这些聚(衣康酸盐-柠檬酸盐-辛二醇)(PICO)弹性体被进一步用作心脏组织补片,以提供必要的弹性支撑,并形成可见的组织结构和活力。
最近,人们对动态共价配位键的兴趣日益浓厚,这种配位键为丰富机械性能范围和引入自愈特性提供了一种新方法,它能在分离或损坏的界面之间进行分子结合。配位配体可与不同种类的金属离子结合并形成不同的配位键,从而赋予聚合物网络多功能性。不同配位键的强度不同,从而导致聚合物具有不同的机械性能和生物降解性。研究人员利用单体癸二酸和 1,3-丙二醇与希夫碱配位键配体(2-[[(2-羟基苯基)亚甲基]氨基]-1,3-丙二醇 (HPA))研制出了聚酯弹性体(图 2A)。与生物相关的金属离子,如 Mg2+、Ca2+、Fe3+、Cu2+、Zn2+ 和 Co2+,通过不同的金属与配体比例和配体密度与聚合物混合,以提供具有各种机械性能的材料。这些弹性体的生物相容性与 PCL 相当,在软组织再生方面具有广阔的应用前景。研究人员设计了具有动态配位键的 PCL 基弹性体,使其韧性达到 372 MJ m-3,断裂能达到 646 kJ m-2。原邻苯二酚(PA)作为扩链剂,Fe3+ 用于铁-邻苯二酚配位。所获得的弹性体具有生物相容性,可用作手术缝合线以改善伤口愈合。
非共价相互作用也被用于改善聚酯弹性体的弹性和坚固性。在弹性体中引入氢键是调整其性能的有效方法。例如,2-脲基-4[1H]-嘧啶酮(UPy)是一种超分子组合物,最近被广泛研究,因为它可以通过形成四重氢键来改善弹性体的性能。用 UPy 基团官能化的 PCL 已被证明能增强弹性,这是因为可逆的分子间氢键有助于能量消耗。此外,一些经 UPy 修饰的生物活性分子可与弹性体中的 UPy 分子结合,为支架提供额外的功能。研究人员在基于聚(ε-癸内酯)(PDL)的聚酯弹性体中引入了离子相互作用。锂离子或钠离子被添加到以 -COOH 基团为端基的聚酯中,形成羧酸盐,以提高离子化弹性体的拉伸强度和弹性(图 2B)。

心脏组织工程(CTE)是组织工程(TE)的一个重要分支,其目标是创建一种细胞-支架结构,以促进心脏组织的修复。心肌组织结构复杂,由各种细胞类型组成,包括心肌细胞、成纤维细胞、平滑肌细胞(SMC)、内皮细胞(EC)以及由纤维蛋白、胶原蛋白和弹性蛋白组成的细胞外基质(ECM)。细胞和 ECM 都对心脏的弹性机械特性和生理功能做出了贡献。ECM 在促进细胞相互连接、传递信号和保持组织的机械特性方面至关重要。典型人体心肌组织的舒张末期杨氏模量为 0.2-0.5 兆帕,拉伸强度为 3-15 千帕,显示了其高弹性 . 据报道,促进心肌组织修复的方法多种多样,包括努力复制原生心肌的微环境、刺激心脏细胞的募集和分裂、改善组织血管化以及调节与修复相关的因子的分泌等。
据报道,有多种策略可开发出与宿主心肌组织机械性能相匹配的聚酯支架。聚酯可与其他聚合物、无机填料混合,或用不饱和键修饰,以获得合适的机械性能和生物降解率。例如,将 PGS 与多嵌段热塑性聚合物聚(丁二酸丁二醇酯)(PBS-DLA)混合,可获得具有所需性能的材料,用于心脏再生。得到的弹性体具有更高的机械性能:当 PBS-DLA 含量从 30% 增加到 60% 时,储存模量 E 几乎翻了一番,从 23±11 兆帕增加到 39±7 兆帕。而且复合材料补片的降解速度比 PGS 慢,更适合用于心脏补片。在 PBS-DLA 含量较高的心脏贴片上观察到 C2C12 细胞存活率增加。研究人员设计了不饱和聚酯弹性体(聚(衣康酸-柠檬酸-辛二醇)(PICO)),并在 POC 的共聚过程中使用衣康酸作为共聚单体(图 3A)。通过调整交联密度,PICO 弹性体可在 36-1476 kPa 的范围内显示出可调的弹性,并被证明可支持心脏组织的组织和活力。为了使不饱和聚酯更好地附着在心脏组织上,研究人员报道了一种通过在聚马来酸(邻甲基马来酸(酐)柠檬酸盐)(POMaC)聚合物中引入多巴胺(DA)而获得令人满意的粘合强度的弹性体贴片。由于多巴胺与组织之间的相互作用,生物相容性粘合补片对心脏组织显示出良好的粘合强度(~0.43 N/cm2),优于 POMaC 和纤维蛋白胶(~0.11 N/cm2 和~0.16 N/cm2)。补片的弹性模量为 51.4 ± 4.1 kPa,与心脏组织相似。
此外,与其他生物活性聚合物或无机填料混合可赋予支架治疗效果和更好的组织恢复能力。PGS 与聚吡咯(PPy)混合,制成了一种半导体聚合物薄膜,作为心脏修复贴片。由于心脏组织具有机电特性,导电成分的引入有助于心脏组织的成熟。最近的一些专利介绍了针对 CTE 的聚酯弹性体结构设计。例如,1,2,4-丁烷三羧酸与丙二酸酐和 1,8-辛二醇缩聚,使聚合物具有紫外线交联的功能。这种材料经模塑和紫外线交联后可制成网状结构或具有定制形状/尺寸的多孔支架。通过优化单体比例,可以调整弹性体的特性,使其与心肌的特性相匹配。作为潜在植入物的支架支撑材料,这些弹性体还表现出接近白蚁的降解行为。在另一项专利中,开发了六亚甲基二异氰酸酯 (HDI) 交联 PGS(PGSU)弹性体,以模拟组织的粘弹性能。
为了生成厚度适宜的多孔支架以促进心脏细胞增殖,人们探索了不同的制造技术。溶剂浇注、电纺丝、微图案化和三维打印是最常用的 CET 支架制造方法。研究人员使用苯胺作为导电成分,制作出了具有电活性的 PGS-苯胺弹性支架(图 3B)。这些薄膜具有电活性特性和适当的弹性模量,可支持心脏组织再生;杨氏模量为 20.2 ± 3.6 兆帕,伸长率为 27% 至 141%。该支架具有生物可降解性,微图案化制造方法提高了大鼠心肌母细胞衍生的 H9c2 细胞的活力和增殖能力,脊面还能引导心肌细胞的排列和伸长。薄膜的生物相容性测试证明,其生物反应与 PGS 组对照相似,具有良好的生物相容性。研究人员使用生物相容性良好的 PCL 和 PGS 混合物设计了一种弹性心脏支架,并采用三维打印技术获得了具有规则图案的丝状结构和相互连接的微孔。该支架显示出卓越的机械性能,并可通过三维打印技术定制形状。PCL-PGS 的杨氏模量为 748.5 ± 21.0 kPa,拉伸强度为 748.5 ± 21.0 kPa,伸长率为 57.3 ± 1.3%。在心肌梗塞模型中,植入的 PCL-PGS 支架可促进心脏功能。使用 PLGA、PCL 或这两种聚合物的组合,通过溶剂浇铸法制造了柔性微针阵列。这种微针阵列具有灵活的机械特性,便于患者安全佩戴。由于接触面积更大,药物输送能力也得到了提高。
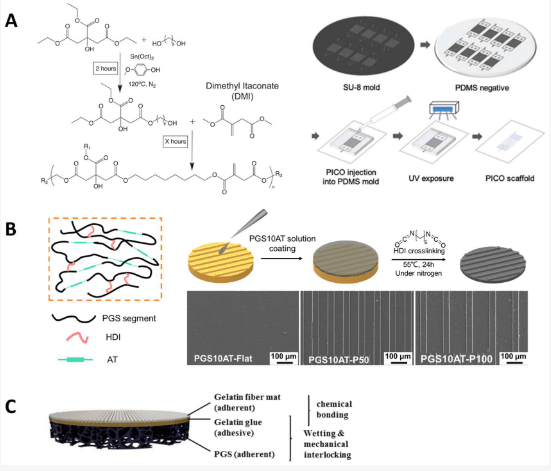
聚酯还与天然聚合物相结合。天然聚合物为细胞粘附和增殖提供了重要的配体(如精氨酸-甘氨酸-天冬氨酸(RGD)三肽单位,几乎存在于所有 ECM 蛋白纤维连接蛋白中)。天然聚合物的主要降解产物是无害的,因此引发的免疫反应很小。研究人员设计了一种基于多孔 PGS 基质的分层支架。在基底上沉积了一层电纺明胶纤维毡,中间层是明胶。附着力和降解测试表明,明胶胶合通过形成化学键将所有成分粘合在一起,即使在磷酸盐缓冲盐水中保存两周,也能显示出较好的效果:交联明胶相对稳定,PGS 基质仍能粘合在一起。这些结果表明,由多孔 PGS 基质和电纺生物聚合物纤维组成的分层心脏补片在 CTE 方面具有潜力(图 3C)。
除了预成型支架外,可注射聚酯的开发也简化了材料的应用过程。研究人员报道了一种使用光固化聚酯向心脏组织递送细胞外囊泡 (EV) 的控释策略,旨在改善肌肉损伤。将 PGSA-g-EG 混合物注入受影响的心肌,并用 LED 灯(405 纳米)在原位进行光交联。作者证明,这种成分不会影响 EV 的生物活性,而且由于体内表面侵蚀降解,可以控制 EV 的释放达两周之久。使用 H9c2 大鼠心肌细胞对 PGSA-g-EG 进行的体外细胞毒性测试和使用雄性 Wistar 大鼠进行的体内生物相容性实验表明,当聚合物应用于组织时,不会产生毒性,也不会发生形态改变。
血管组织由细胞、蛋白质和 ECM 组成,形成管状分层结构。典型的血管组织具有粘弹性机械特性,其抗拉强度约为 4.3 兆帕,爆破压力高达 3000 毫米汞柱。血管组织的一个特殊生物功能是可以防止血小板粘附。据报道,有几种促进血管组织修复的策略,包括模仿天然血管组织结构、防止血小板粘附、改善内皮化、输送和释放生物活性材料等。在聚酯弹性体材料方面,编织、电纺丝、盐浸出和三维打印等方法已在血管TE应用中得到探索。
对于动脉血管组织工程而言,需要强韧的生物可吸收支架来提供临时强度,即在愈合过程完成之前保持扩张的血管并抵抗血管反冲。为了获得适当的生物可吸收性和机械性能,研究人员设计了由 PGA 和 L-PLGA 纤维编织而成的支架。然后,在编织支架上涂覆四臂聚(乙二醇-共己内酯)(PGCL)弹性体,该弹性体由 HDI 交联而成(图 4A)。与没有涂覆的支架相比,涂覆了弹性体的支架显示出更高的压缩强度和弹性(约 700 mmHg 对约 100 mmHg),这是用激进刚度(RRF)测量的。它们的扩张性能也得到了改善,与金属支架相似,满足了血管治疗的扩张要求,用慢性向外力(COF)测量,数据为 ~150 mmHg 对 ~30 mmHg。弹性体的机械性能可通过改变其分支结构、交联密度和分子量进行调整。这些支架作为血管植入物的应用前景广阔。他们通过绵羊模型对其生物相容性进行了评估,结果发现炎症低于中等程度,这表明其作为血管植入物的生物相容性是可以接受的。研究人员还报道了一种生物可吸收支架,它由聚对二氧杂蒽酮(PPDO)单丝和聚己内酯/聚对二氧杂蒽酮(PCL/PPDO)核壳复合纱线编织而成。对生物可吸收支架的降解曲线进行了优化,以配合血管重塑过程并促进愈合。一些专利中还描述了由聚酯制成的自膨体支架。例如,一种设计包含一个由生物可吸收金属镍钛诺制成的内支架和一个由聚乳酸(PLLA)或聚丙烯酰胺(PGA)组成的外支架。外层被设计成可在体内吸收,从而使内支架扩张到更大的直径。最近,研究人员利用盐浸法报道了基于 PGS 的多孔血管移植物(图 4B)。他们在 PGS(棕榈酸-PGS,PPGS)中引入棕榈酸,以减缓材料的降解,并与颈总动脉(CCA)的体内再生同步。与 PGS 相比,PPGS 的杨氏模量更低,水接触角更大。所制备移植物的降解时间从 4 周到 12 周不等,比 PGS 的降解时间要长,PGS 的降解时间约为 2 周。当植入大鼠颈总动脉时,PPGS 更好的血管导管再生结果也证明了其与再生速度相匹配的缓慢降解改性,这可以提高血管移植物在转化为自体血管导管过程中的整体性能。
基于 POC 的弹性体一直是血管 TE 的广泛研究课题。除了良好的机械性能和生物相容性外,POC 弹性体还具有较低的血小板粘附性和凝结性、最小的溶血性和适当的蛋白质吸附性,表明其具有良好的血液相容性 . 研究人员制作了全反式维甲酸(atRA)-POC(POCR)涂层膨体聚四氟乙烯(ePTFE)(POCR-ePTFE)血管移植物,促进了血管内皮化。这种材料的性能结合了之前报道的 POCR 和 POC-ePTFE 的优点。atRA用于抑制血管内膜增生,加速血管再内皮化;ePTFE用作支架材料。体内实验显示,atRA-POC-ePTFE 在血管再生方面的表现优于之前的 atRA-ePTFE。尿烷掺杂和不饱和聚酯掺杂已被用于调整 POC 的机械性能,以适应血管应用。例如,在 POC 骨架中加入马来酸酐和衣康酸来制造血管支架。研究人员研究了不同单体比例的柠檬酸聚(八甲基马来酸(酐))(POMaC),以调整其弹性,弹性范围为 5.4 千帕至 60.1 千帕。制成的形状记忆支架具有不同的图案和几何形状,可注射并用作主动脉支架。

三维打印工艺是制造定制血管移植物的一种经济有效的方法。研究人员使用由伊塔康酸二甲酯(DMI)、柠檬酸三乙酯(TEC)和 1,8 辛二醇(OD)合成的预聚物,通过三维打印技术制备了聚(伊塔康酸二甲酯-柠檬辛二醇)(PITCO)血管管(图 4C)。通过紫外线照射,血管管在短时间内交联成型。它们的弹性模量在 11-53 kPa 之间,随成分比例的变化而变化,符合心脏组织的力学原理。这些血管管能有效支持脐静脉内皮细胞的粘附和增殖,从而支持心脏组织的形成。由于材料具有半渗透性,这些支架还能进行氧气/营养和代谢废物的交换。
神经创伤治疗一直是 TE 的重要组成部分。成人周围神经系统的恢复功能有限,因此必须采取医疗干预措施才能达到更好的再生效果。传统的治疗方法包括自体神经移植,但受限于自体神经供应有限、需要二次手术、供体部位并发症、免疫反应和并发症等因素。此外,自体神经移植的临床功能恢复率仅为 80% 左右。近年来,人工神经移植物作为传统神经移植物的替代品被报道并应用于神经组织工程中。除了生物相容性和生物降解性之外,用于神经再生的天然/合成材料还需要具有与神经系统相似的特性/结构,包括渗透性、生化活性和结构。
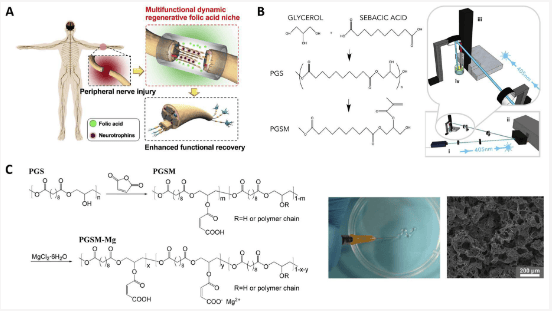
功能化聚酯材料是近期神经 TE 领域的一个焦点。人们在聚酯中混入各种生物活性成分,以赋予其电化学特性或模拟神经系统的生化活动。研究人员制造了一种与 HDI 交联的 PGS-聚苯胺导电薄膜。导电聚苯胺使薄膜能够传导电信号,并通过诱导许旺细胞的髓鞘化和神经营养素分泌促进治疗效果。钛酸钙(CaTiO3)也与 PGS 混合以达到类似的效果。在这项研究中,研究了 Ca2+ 的释放及其对轴突生长的影响。CaTiO3 的导电性能在再生过程中也很重要。加入 CaTiO3 作为增强粒子后,PGS 弹性体的机械性能得到增强。因此,杨氏模量从 0.30 ± 0.05 兆帕增加到 1.06 ± 0.08 兆帕。此外,有研究表明,钙可以促进神经细胞的发育,促进神经细胞之间的功能连接,从而促进神经再生。研究人员报道了由不同单体比例的 PGS 和 PCL 组成的用于神经引导导管的聚合物基质。其中添加了石墨烯纳米片作为导电填料,以改善机械性能和促进生物特性。PGS 对细胞行为有积极影响。研究人员在 HDI-POC 中掺入叶酸,制成了神经引导导管(fCUPE)(图 5A)。凭借量身定制的支架机械性能和叶酸的调节功能,fCUPE 导管对周围神经系统的再生和功能恢复产生了积极影响。细胞毒性和增殖试验证明叶酸对细胞无毒性。
还研究了神经 TE 中的不饱和基团修饰。研究人员报道了用于神经再生的甲基丙烯酸化 PGS(mAcr-PGS)神经引导导管(NGCs)。这些 mAcr-PGS 管具有柔韧性、抗扭结性和耐缝合性,因此适合用于较大间隙模型(图 5B)。此外,体外分析表明神经元在 NGC 沟槽内伸长和排列,并观察到神经元和神经胶质细胞的生长。在体内实验中,mAcr-PGS 导管可促进轴突再生,引导轴突生长,而且不会导致神经病理性疼痛加剧。研究人员设计了一种 PGS 马来酸盐和镁离子的混合物(PGSM-Mg)。Mg2+ 通过配位键与聚合物相互作用。获得的弹性体保持了其柔软性,可通过三维打印技术制成具有定制孔隙率的弹性支架。这种支架改善了许旺细胞(SCs)的细胞粘附和增殖(图 5C)。
在过去几十年中,由于人口老龄化以及骨创伤和癌症病例的增加,骨损伤的发病率显著上升。为此,骨组织工程(BTE)得到了迅速发展,以提供生物材料作为传统骨移植的替代品。针对 BTE 研究的材料包括陶瓷、聚合物、生物活性药物及其复合材料。在这些材料中,骨诱导性生物材料前景看好。这些生物材料能够通过影响体内环境来诱导骨形成。骨诱导能力已在多种生物活性材料中发现,如磷酸钙(CaPs)、羟基磷灰石(HA)、β-磷酸三钙(β-TCP)和生物活性玻璃。用于骨 TE 支架的聚酯包括 PCL、PLA、PGA 及其共聚物。一般来说,用于 BTE 的支架应具有生物相容性、生物可降解性、骨诱导性和适当的机械性能。在聚酯弹性支架中加入陶瓷颗粒或在陶瓷支架中注入聚酯是改善支架机械性能的常用方法,使其适用于骨再生。
大多数用于骨再生的聚酯弹性体都与生物活性成分相结合。柠檬酸酯基聚酯在 BTE 应用中显示出了巨大的前景,其多功能的化学特性使其有可能负载各种促进骨生成的生物活性材料。研究人员开发了一种由二氧化硅纳米颗粒(SN)增强的可生物降解聚(柠檬酸酯-硅氧烷)(PCS)混合弹性体(PCS-SN)。二氧化硅纳米颗粒均匀地分散在支架中。通过调整 SN 的重量比,可以调节 PCS-SN 弹性体的机械性能和生物降解性。PCS-SN 弹性体具有良好的组织相容性,能够促进成骨细胞的粘附和增殖。另一种 PCS 基混合弹性体加入了生物活性玻璃纳米颗粒(BGNs),有助于生物矿化活动,促进骨组织再生。研究人员设计了一种涂有羟基磷灰石(HA)的基于 POC 的骨再生材料,可防止无机/有机相分离(图 6A)。作为一种天然骨成分,HA 在木材融合中发挥着重要作用,并能提高材料的机械性能。在 HA 表面涂覆单宁酸(TA),银纳米粒子与 HA 表面相互作用,赋予其抗菌活性。基于 POC 的单宁酸桥接骨复合材料(CTBCs)的压缩强度显著提高,最高可达 323.0 ± 21.3 兆帕。这些复合材料具有良好的生物相容性,可促进细胞粘附、增殖和生物矿化性能。在兔子身上进行的腰椎融合模型实验证明了 CTBCs 的骨诱导、骨诱导和骨再生促进特性。研究人员利用由柠檬酸、1,8-二辛二醇和 L-丝氨酸与 HA 反应合成的本征荧光柠檬基聚酯,报道了一种可监测材料降解动力学的骨腻子(BPLP-Ser/HA)。这种复合材料显示出与早期非矿化骨相匹配的机械性能(压缩强度和初始模量)。骨腻子具有延展性,可以轻松压入不规则的缺损处,这表明它具有与骨蜡同等的处理特性。这种骨腻子在大鼠小腿模型中表现出体内生物相容性和成骨潜力。
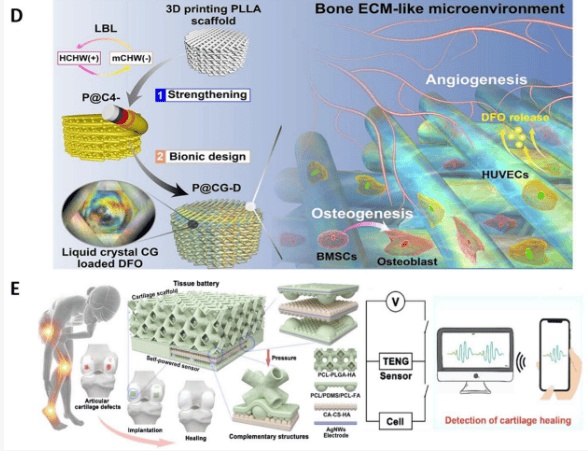
过去几十年来,三维打印支架因其独特的三维多孔结构而备受关注,这种结构可提供所需的孔隙率和良好的机械性能。这使它们能够近似模拟天然骨小梁。多孔结构是支架的基本要素,可为细胞粘附、增殖、分化和生物矿化提供有利的微环境。此外,生物活性线索也是创造协同微环境、加速骨再生过程的必要条件。在最近的骨再生研究中,PCL 和 PLA 因其出色的可印刷性、机械性能控制能力和生物降解性而得到广泛应用。由于骨再生是一个持续而复杂的过程,其中血管生成和骨生成密切相关,因此结合生物活性材料的三维打印支架用于血管生成和骨诱导是骨缺损治疗的常用方法。研究人员制作了一种基于 PCL 的可生物降解支架,该支架可输送去铁胺(DFO),这是一种经 FDA 批准的铁螯合剂,具有促进血管生成和骨再生的潜力。PCL 支架是通过三维打印技术制造的,DFO 是通过 PCL 表面的氨基溶解和逐层组装的方式载入的(图 6B)。PCL-DFO 的抗压强度为 2.7 ± 0.3 兆帕,与松质骨的抗压强度相当。细胞活力和增殖测试表明,三维打印 PCL 支架具有良好的生物相容性,DFO 对细胞生长没有明显影响。对 PCL 支架和 PCL-DFO 支架的进一步分析表明,DFO 的加入对体内血管生成和成骨至关重要,而 PCL-DFO 支架的降解情况与骨骼发育和重建相匹配。三维打印支架也有专利报道。例如,研究人员描述了一种由α-酮戊二酸和 1,2-丙二醇合成的聚酯树脂。他们采用低温三维打印技术制造了具有优化孔径的骨支架。另一种聚酯树脂聚丙烯富马酸盐(PPF)被合成为一种光固化材料,可用作骨再生支架。PPF 的粘度为 24 Pa-s,高于光固化 3D 打印用聚合物的一般粘度。因此,PPF 可以溶解在溶剂中,然后在 2 小时内打印成多孔骨支架。

由于骨再生过程受到多种生物活性分子的调控,双药或多药给药支架被广泛用于促进骨再生。混合支架是一种很有前景的方法,既能与骨微环境相匹配,又能携带细胞,还能递送多种生物活性药物。研究人员通过组装含有介孔二氧化硅纳米颗粒的电纺纳米短纤维,并在其中添加二甲基环氧乙烷(DMOG),开发出一种仿生物支架。这与由含有锶(Sr)的 HA 和 PCL(SrHA-PCL)制成的 3D 打印支架相结合(图 6C)。SrHA-PCL 支架的压缩模量为 29.85 ± 4.75 兆帕,机械应力为 1.87 ± 0.13 兆帕。电纺纳米纤维的降解速度快于 SrHA-PCL 支架,有利于 DMOG 和 Sr 离子的定制释放。实验证明,这种支架具有生物相容性和血管生成功能。这种顺序释放加速了骨组织的生长,促进了血管化骨再生。研究人员报道了一种模仿骨 ECM 的聚乳酸三维打印支架(图 6D)。通过逐层方法将甲壳素晶须静电自组装在 PLLA 表面,以增强 PLLA 支架。然后,将 DFO 包封在壳聚糖/甲壳素晶须水凝胶中,该水凝胶呈现出类似 ECM 的液晶状态和粘弹性。然后,将水凝胶引入增强聚乳酸支架,以创造一个模拟骨 ECM 的微环境。所获得的支架能有效促进血管生成和骨生成。PCL 还可以作为三维打印水凝胶支架的涂层,形成核/壳混合支架。水凝胶模板由明胶、海藻酸盐、壳聚糖或它们的混合物制成。牺牲型水凝胶模板的降解速度比 PCL 快得多,因此会产生空心通道支架,因为会留下核心空间。这些中空通道可作为独特的建筑线索,促进骨形成和血管化。
近年来骨再生研究的另一个趋势是引入生物功能,包括电活性、导电性、形状记忆特性和光热效应。通过引入基于多凸三电纳米发电机(TENG)的传感器,可以实现对再生状态的实时监测(图 6E)。例如,研究人员报道了在 HA/PLGA 支架中引入樟脑磺酸掺杂聚苯胺(PANI)的导电多孔支架。这种导电支架有利于成骨,PANI 还能调节支架的降解行为,防止因 PLGA 体积侵蚀而导致的机械功能严重受损(图 7)。最近,报道了一种光电复合支架,它由具有特定图案的硅(Si)薄膜和医管局-胶原蛋白/ PCL 组成。硅薄膜可产生电信号,并在外部光线照射下与组织相互作用,从而调节细胞行为。HA 胶原/PCL 构成多孔基质,可在地形和机械上支持细胞生长和分化。经测试,硅薄膜具有理想的生物相容性。这种仿生多尺度分层结构的支架具有生物相容性,并能提高骨再生效率。
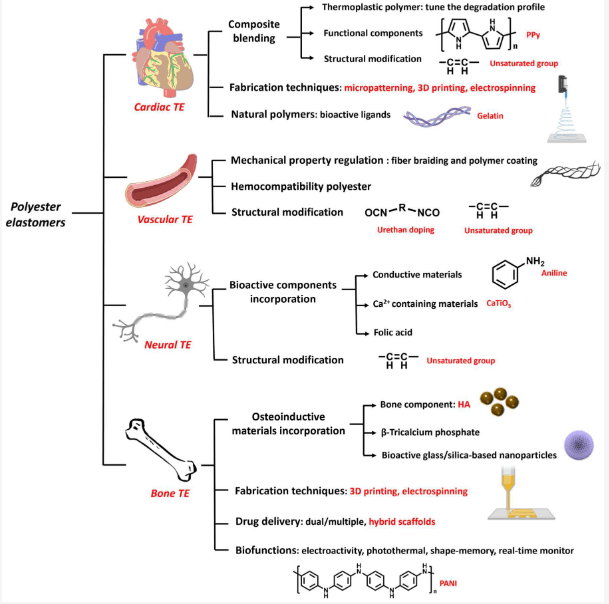
人们对将刺激响应型高弹性器件应用于植入式或可穿戴式电子设备和柔性传感器的兴趣与日俱增。可穿戴传感器应具有生物相容性,并与宿主组织的机械特性相匹配。因此,这些弹性体的伸展性和可压缩性至关重要。用于可穿戴电子设备的商用弹性体(如聚对苯二甲酸乙二醇酯、聚酰亚胺、聚乙烯、丙烯腈-丁二烯-苯乙烯、聚苯乙烯-乙烯-丁烯-苯乙烯和聚二甲基硅氧烷)通常具有很高的硬度,这可能会导致触感不适。因此,人们需要开发包括聚酯弹性体在内的柔性生物弹性体。用于短期应用的传统植入式生物电子器件存在一些局限性,如机械性能不足、感染风险以及在完成治疗或监测后需要进行移除手术等。为了克服传统植入物的缺点,人们开发了聚酯弹性体,因为它们具有可溶解或就地降解的能力。最近开发的生物电子应用聚酯弹性体包括基于 PGS 的弹性体、基于 POC 的弹性体和基于 PCL 的弹性体。
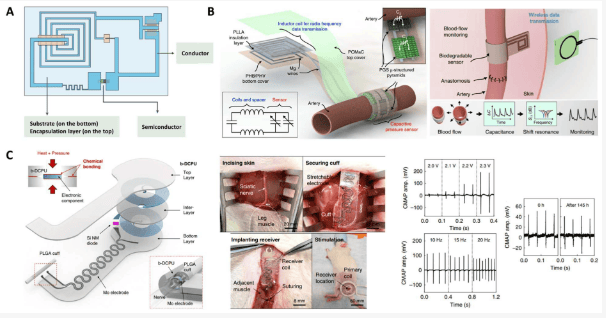
为了制造植入式电子元件,开发了绝缘和可生物降解的聚酯弹性体作为封装层、基底和介电材料。在生物可吸收电子器件中,封装层保护电极不受外部环境的影响。封装层使用的材料决定了电子器件的暴露程度。基底为微电子制造提供了平台,而电介质材料则赋予了电子器件的功能(图 8A)。所有这些生物可吸收材料的降解率决定了设备的使用寿命。研究人员创造了一种可生物降解的压力传感器,可以高灵敏度测量动脉血流。通过采用边缘场电容器技术,血流信号可以通过接触和非接触两种方式进行检测。该传感器由压力敏感区域的微结构 PGS 介电层、POMaC 和聚羟基丁酸/聚羟基戊酸(PHB/PHV)封装层以及双层线圈的聚乳酸(PLLA)间隔层组成(图 8B)。所有层都是超薄薄膜,并与镁(Mg)电极层压在一起,制成传感器。研究人员利用由 PCL 三醇和 HDI 合成的动态共价弹性体(b-DCPU)作为生物可吸收无线刺激装置的封装层。热激活的动态键交换反应实现了 b-DCPU 层间的强健自键合,使层间具有良好的界面韧性(图 8C)。该装置在大鼠模型中进行了 30 天的坐骨神经刺激,保持了其监测灵敏度,表明该装置具有稳定和较长的使用寿命。
聚酯弹性体具有出色的弹性特性,已被用作可穿戴生物传感器的基底。人们在聚酯中加入了金属、纳米管、纳米线、纳米片、聚(乙烯二氧噻吩):聚(苯乙烯磺酸)(PEDOT:PSS)等导电聚合物、离子液体和半导体聚合物等导电成分,以改善其电化学性能。研究人员设计了一种由弹性多孔 PGS 组成的灵敏压阻传感器。其中加入了多壁碳纳米管 (MWCNT),以提高其机电性能。这种柔性传感器灵敏度高,能够在 20 毫秒的响应时间内检测到低至 100 帕的压力。研究发现,PGS 的泡沫结构有助于提高传感器的灵敏度。用 PEDOT:PSS 和 CNTs 功能化的 PGS-urethane 制造了一种应变传感器,它具有生物相容性和生物可降解性。研究人员利用 POC 基底与可生物降解的金属 Mg 结合制作了一种皮肤传感器,用于测量生物电位和 pH 值。研究人员利用可生物降解的弹性体聚(1,8-辛二醇-柠檬酸-己内酯)(POCL)与导电离子液体(IL)1-乙基-3-甲基咪唑鎓双(三氟甲基磺酰基)亚胺([EMI]+ [TFSI]-)制成了应变传感器(图 9A)。他们利用分子量(Mw)大于其缠结分子量(Mc)的 PCL 二元醇设计了缠结柔性链,从而使传感器具有良好的回弹性和低滞后性。POCL 的拉伸强度为 0.20 兆帕,伸长率为 770%,具有适用于表皮电子器件的机械性能。基于 POCL 的应变传感器具有自粘性,可以紧贴皮肤表面,有助于实现高灵敏度和快速响应。
基于聚酯的可穿戴生物传感器的最新发展还集中在对聚酯结构进行改性,以获得更符合人体皮肤的机械性能,并赋予其自愈合特性,从而提高传感器的耐用性和可靠性。研究人员利用化学和物理交联技术设计出了聚(癸二酰 1,6-己二胺二甲酸二甘油酯) (PSeHCD) 弹性体。聚氨酯单元引入了氢键作为动态物理键,有助于提高自愈合性能。在制造应变传感器时,将这些弹性体涂上 PEDOT:PSS 并显示实时信号输出。研究人员设计了一种聚(癸二酸二甘油酯)(PSeD)-接枝-Upy(PseD-U)弹性体,用于压电压力传感器的介电层(图 9B)。通过牺牲氢键,Upy 单元的加入提供了有效的能量消耗。由于物理交联和共价交联的结合,PseD-U 弹性体显示出与人体皮肤相似的机械性能(杨氏模量为 0.64 ± 0.10 兆帕、拉伸强度为 0.73 ± 0.10 兆帕、伸长率为 297 ± 16%)。使用微结构 PseD-U 弹性体和金涂层 PCL 薄膜制作的压电压力传感器显示出较高的压力灵敏度和快速响应,证明 PseD-U 弹性体是可穿戴电子设备的合适基底材料。
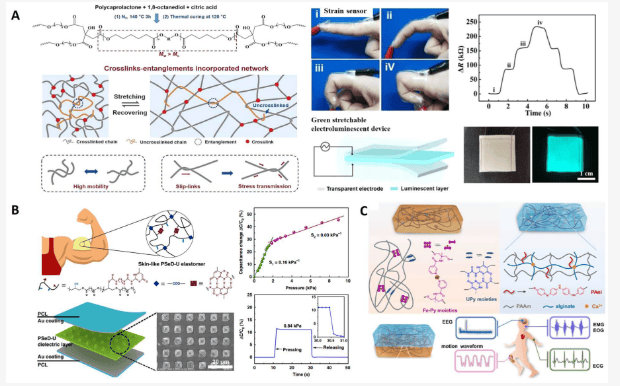
在生物电子设备中,弹性体还与导电水凝胶结合使用。仿生多层结构在人体组织中无处不在,为生物电子器件的开发提供了灵感。为了模拟生物组织的异质结构(其中不同组织层的机械性能和生物功能各不相同),先进的柔性电子器件中集成了韧性弹性体和可拉伸水凝胶。一般来说,弹性体的模量要与水凝胶的模量相匹配,因为低模量的水凝胶可能会因运动伪影的存在而导致信号噪声。研究人员将韧性弹性体与导电水凝胶相结合,制成了一种电子信号更强的传感器,在检测心电图(ECG)方面可与商用银/氯化银电极相媲美(表 2)。具有高模量和高拉伸性的弹性体(CPU-Fe-Py-U)是以聚(ε-己内酯-co-DL-内酯)-甘油(G-PLCL)聚酯骨架为基础合成的。Upy是提供氢键的物理交联剂,N-(1,3-二羟基-2-甲基丙-2-基)吡啶-3-甲酰胺是与Fe3+相互作用的配位配体。通过四重氢键和配位键的协同作用,既可调节交联密度,又可调节聚合物链的柔韧性,从而获得理想的机械性能。所得弹性体的拉伸强度为 11.52 兆帕,伸长率为 1150%。含有聚苯胺(PANI)的导电水凝胶是敏感组分。这种弹性体水凝胶混合结构传感器作为皮肤传感器具有灵敏度高、响应速度快(10 毫秒)的特点(图 9C)。
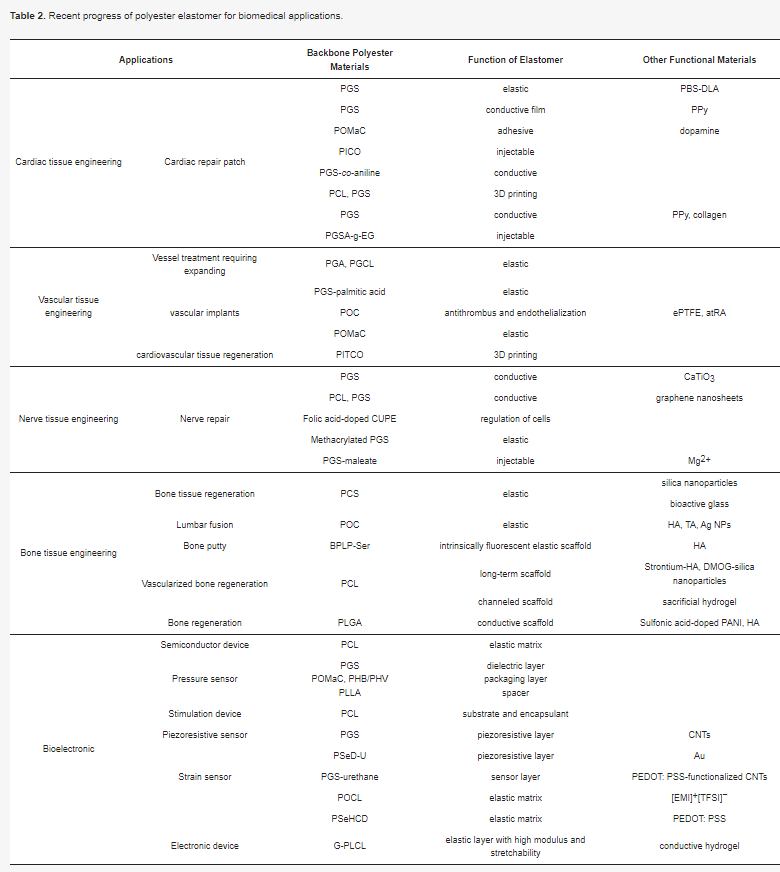
聚酯弹性体在各种生物医学应用中展现出巨大潜力,包括心脏、血管、神经和骨组织工程以及生物电子学。聚酯材料具有生物相容性和体内生物可降解性,因此在这些生物医学应用中大有可为。近年来,人们对具有优异机械和生物特性的聚酯弹性体越来越感兴趣,这些弹性体可以通过探索创新的聚合物合成/改性方法和共聚策略来开发。此外,材料加工技术也得到了进一步发展,使材料与目标应用相匹配。此外,聚酯弹性体通常与生物活性材料相结合,以提供反应位点、引入治疗效果和/或提供仿生微环境,从而改善组织再生。总之,在生物医学应用中,探索聚酯弹性体用于生物医学治疗正成为一种极具吸引力的策略。
尽管聚酯弹性体的发展突飞猛进,但该领域仍有几个方面需要进一步的工作和探索。首先,聚酯弹性体的结构设计仍有改进空间,以实现更好的性能和更广泛的应用。有必要进一步研究创新合成策略,以赋予材料多种功能。其次,聚酯弹性体的形状记忆和可注射性等特性需要进一步探索,因为它们在提供简便的微创手术方面具有巨大潜力。这些特性的应用可扩展到心脏修复补片、用于体内监测的生物电子器件或骨修复支架。第三,可以进一步改进混合支架的制造方法。与植入物类似,由聚酯弹性体和生物活性成分组成的混合支架通常比聚酯弹性体显示出更好的治疗效果。现有的方法大多是将聚酯与生物活性成分直接混合,然后分别制造不同的层,再将它们组装在一起。因此,需要采用集成加工方法来简化制造过程。此外,三维制造方法也有待调整,以便在制造混合支架时控制三维结构的孔隙率和孔径。与其他技术(电纺丝、盐浸法)相比,三维打印技术可以保留细胞的活力和功能,使原位生物打印成为可能。要加工出具有合适机械性能和生物活性的聚酯和水凝胶/天然聚合物复合材料,仍然是一项挑战。由于混合支架和多层弹性支架的设计可模拟天然组织,因此已被广泛研究。然而,聚酯弹性体与其他层之间的相互作用还未得到充分研究。据报道,二苯甲酮是一种光引发剂,当混合水凝胶/弹性体结构在紫外线下交联时,弹性体和水凝胶之间会形成化学作用。如何使混合材料中的弹性体和其他亲水成分之间产生强烈的化学或物理相互作用,是进一步研究促进生物电子学发展的一个有趣课题。最后,开发具有特殊性能的新型生物相容性单体和聚酯弹性体也很有吸引力,尤其是一些生物基单体。生物基聚酯弹性体已证明其在组织工程中的独特功能,因为支架的设计有助于某些代谢功能,如柠檬酸代谢源调节,促进成骨分化。因此,探索新型生物基聚酯弹性体及其在组织工程中提供生理功能的作用将是一个前景广阔的领域。